揭秘!电子式书写的正确方法与技巧,一看就会的实用指南
在化学的广阔天地里,电子式作为一种直观表达原子间电子排布与化学键形成的工具,不仅揭示了物质构成的微观秘密,也是化学学习者探索分子世界不可或缺的语言。对于初涉化学殿堂的你来说,掌握电子式的书写技巧,就像是拥有了一把打开原子结构奥秘之门的钥匙。今天,就让我们一起踏上这场探索之旅,揭秘电子式书写的奥秘。
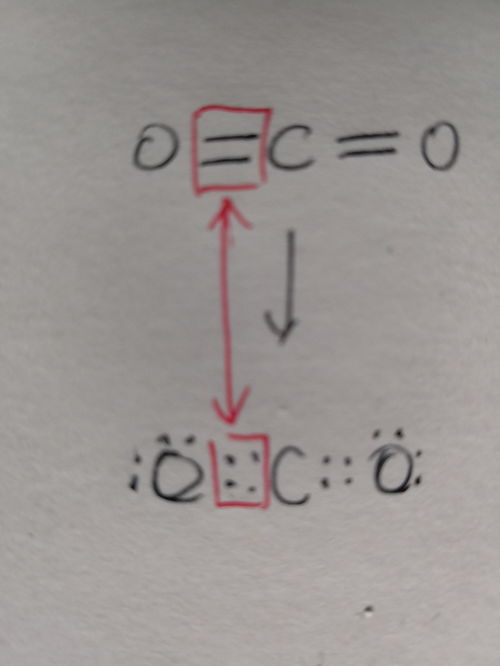
一、电子式的基本概念
首先,让我们从基础出发,理解什么是电子式。电子式,简而言之,就是用“·”或“×”来表示原子最外层电子排布情况,并用元素符号和短线“-”或箭头“→”(在某些情况下表示配位键)来连接原子,展示分子或离子中原子间电子的成键状态和分布的一种化学表示法。它不仅能够清晰展示原子如何通过共享或转移电子来形成化学键,还能帮助我们理解物质的化学性质和反应机理。

二、书写电子式的基本步骤
1. 确定元素的价电子
每种元素都有其特定的价电子数,这些价电子是决定原子间如何相互结合形成化学键的关键因素。在书写电子式之前,首先需要熟记常见元素的价电子数,特别是前20号元素,它们构成了化学世界的基石。
2. 画出原子的电子排布
对于非金属原子,通常在其元素符号周围用“·”或“×”表示其最外层的电子。例如,氢原子(H)的最外层有一个电子,可以表示为H·;氧原子(O)最外层有六个电子,则写为O··。注意,这里的“·”或“×”只是用来表示电子的存在,并无实际数量限制,关键是体现出最外层的电子数。
3. 判断化学键类型
接下来,需要分析原子间是如何通过电子的共享或转移来形成化学键的。共价键常见于非金属元素之间,表现为电子的共享;而离子键则通常发生在金属与非金属之间,涉及电子的完全转移。例如,在氯化氢(HCl)中,氢原子和氯原子通过共享电子形成共价键;而在氯化钠(NaCl)中,钠原子失去电子成为阳离子Na⁺,氯原子获得电子成为阴离子Cl⁻,二者通过静电作用结合。
4. 书写电子式
共价化合物:对于共价化合物,按照共价键的形成方式,将各原子的电子排布图进行拼接,同时用短线“-”连接表示原子间的成键关系。如水的电子式可以表示为H:O:H(其中“:”表示电子对,即共用电子对)。
离子化合物:对于离子化合物,则需要先分别写出阳离子和阴离子的电子式,然后将它们靠在一起,用方括号“[]”将阴离子括起来,并在右上角标出所带电荷数(如果是带1个单位电荷的离子,则电荷数可省略)。最后,用短线“-”连接表示离子间的静电作用。如氯化钠的电子式写为Na⁺[∶Cl∶]⁻。
三、特殊情况的处理
复杂离子:对于含有多个原子的复杂离子,如硫酸根离子(SO₄²⁻)、铵根离子(NH₄⁺)等,在书写其电子式时,需先确定每个原子的电子排布,再按照化学键的形成规则进行拼接,最后标出整体所带的电荷。
配位化合物:配位化合物中,中心原子与配体之间通过配位键连接。配位键的书写通常用箭头“→”从配体指向中心原子,表示配体提供的孤对电子被中心原子接受。例如,四氨合铜离子[Cu(NH₃)₄]²⁺的电子式中,四个氨分子作为配体,通过配位键与中心铜离子相连。
四、实践练习与巩固
理论学习之后,最重要的是通过实践来巩固知识。建议选取一些典型的分子或离子,如二氧化碳(CO₂)、氢氧化钠(NaOH)、过氧化氢(H₂O₂)等,尝试自己书写它们的电子式。在书写过程中,不仅要关注电子的分配和化学键的形成,还要注意离子电荷的平衡以及配位键的正确表示。
五、结语
电子式的书写,不仅是对原子结构和化学键形成规律的直观展现,更是化学思维与表达能力的重要体现。通过本文的介绍,相信你已经对电子式的书写有了初步的认识和掌握。但请记住,化学是一门实验科学,理论学习只是起点,真正的理解和掌握还需要通过不断的实践和探索。愿你在化学的海洋中畅游,发现更多未知的奥秘!
- 上一篇: 食指佩戴戒指的寓意全解
- 下一篇: 揭秘:上海何以别称'申城'的由来
-
 揭秘!如何正确书写大写数字,一看就会的实用技巧资讯攻略10-25
揭秘!如何正确书写大写数字,一看就会的实用技巧资讯攻略10-25 -
 手机上轻松查询银行卡余额,一看就会的实用技巧!资讯攻略11-01
手机上轻松查询银行卡余额,一看就会的实用技巧!资讯攻略11-01 -
 《最强祖师》深度揭秘:如何智慧挑选画师战斗弟子?一看就会的攻略指南!资讯攻略10-19
《最强祖师》深度揭秘:如何智慧挑选画师战斗弟子?一看就会的攻略指南!资讯攻略10-19 -
 电脑端轻松登陆微信,一看就会的教程!资讯攻略11-20
电脑端轻松登陆微信,一看就会的教程!资讯攻略11-20 -
 轻松学会!千纸鹤折纸步骤图解,一看就会的简易教程资讯攻略01-24
轻松学会!千纸鹤折纸步骤图解,一看就会的简易教程资讯攻略01-24 -
 如何手工折叠简单的金元宝?一看就会的折法教程资讯攻略02-01
如何手工折叠简单的金元宝?一看就会的折法教程资讯攻略02-01












