揭秘:实验室制取氧气的三大高效方法
实验室制氧气是化学实验中常见的一项操作,对于科研人员、教育工作者以及学生而言,掌握几种有效的制氧方法至关重要。以下是实验室中制备氧气的三种主要方法,涵盖了化学反应原理、所需仪器、操作步骤及注意事项,旨在帮助读者更好地理解并实践这一化学实验。
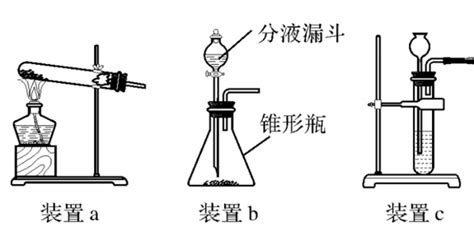
方法一:加热高锰酸钾制氧气
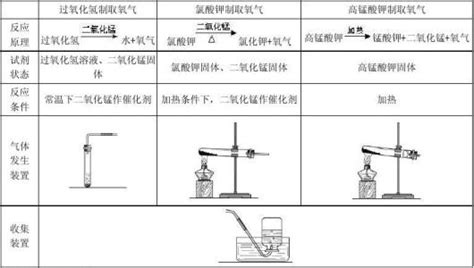
高锰酸钾(KMnO₄)是一种强氧化剂,在加热条件下可以分解产生氧气、锰酸钾(K₂MnO₄)和二氧化锰(MnO₂)。这种方法因操作简便、反应迅速而被广泛采用。

所需仪器:

铁架台
大试管

导管
集气瓶
水槽
酒精灯
火柴
单孔橡皮塞
毛玻璃片
操作步骤:
1. 检查装置的气密性,确保连接处无漏气。
2. 在试管内装入少量高锰酸钾粉末,注意不宜过多,以免反应过于剧烈。
3. 将试管固定在铁架台上,试管口略向下倾斜,以防冷凝水回流引起试管炸裂。
4. 在试管口塞上单孔橡皮塞,通过橡皮塞插入导管,导管另一端伸入集气瓶内,集气瓶装满水并倒立于水槽中。
5. 点燃酒精灯,预热试管底部后,用外焰加热高锰酸钾所在部位。
6. 观察导管口,当有气泡连续均匀冒出时,开始收集氧气。
7. 当集气瓶内水面下降至瓶口附近,用毛玻璃片盖住瓶口,取出集气瓶正放桌上备用。
8. 实验结束后,先撤导管,再熄灭酒精灯,防止水槽中的水倒吸入试管,造成试管炸裂。
注意事项:
高锰酸钾具有腐蚀性,操作时需佩戴防护手套和眼镜。
实验过程中,应远离易燃物品,以防意外。
试管口必须略向下倾斜,防止冷凝水回流。
收集氧气时,需待气泡连续均匀冒出再开始收集,以保证氧气纯度。
方法二:分解过氧化氢(双氧水)制氧气
过氧化氢(H₂O₂)在二氧化锰(MnO₂)的催化作用下,可以迅速分解产生氧气和水。这种方法无需加热,操作更加安全简便。
所需仪器:
分液漏斗或长颈漏斗
锥形瓶
导管
集气瓶
水槽
玻璃棒
二氧化锰粉末
操作步骤:
1. 检查装置的气密性,确保各部件连接紧密。
2. 在锥形瓶底部加入适量的二氧化锰粉末作为催化剂。
3. 通过分液漏斗或长颈漏斗向锥形瓶内缓慢加入过氧化氢溶液,注意控制加入速度,避免反应过于剧烈。
4. 将导管一端插入锥形瓶内,另一端伸入集气瓶中,集气瓶装满水并倒立于水槽中。
5. 观察导管口,当有气泡冒出时,开始收集氧气。
6. 收集满后,用毛玻璃片盖住瓶口,取出集气瓶正放桌上备用。
7. 实验结束后,将锥形瓶内的混合物进行过滤,回收二氧化锰催化剂,以便下次使用。
注意事项:
操作过程中应避免过氧化氢溅入眼睛或皮肤,使用时应佩戴防护装备。
催化剂二氧化锰的用量应适中,过多会影响氧气纯度,过少则反应速率减慢。
收集氧气时,同样需待气泡连续均匀冒出再开始收集。
方法三:电解水制氧气
电解水是将水分子在通电条件下分解为氢气和氧气的过程。虽然这种方法在实验室中不如前两种方法常用,但它提供了一种从基础化学反应角度理解氧气制备的方式。
所需仪器:
直流电源
电解池
两根电极(常用铂电极或碳棒)
导管
集气瓶
水槽
操作步骤:
1. 将电解池内加入适量的水,确保水能够完全浸没电极。
2. 将两根电极插入电解池中,确保电极与电源的正负极正确连接。
3. 开启直流电源,调节至适当的电压,开始电解过程。
4. 观察电解池内,正极(阳极)附近会有气泡产生,这些气泡即为氧气。负极(阴极)附近则产生氢气。
5. 将导管一端连接到正极附近的出口,另一端伸入集气瓶中,集气瓶装满水并倒立于水槽中。
6. 观察导管口,当有气泡冒出时,开始收集氧气。
7. 收集满后,用毛玻璃片盖住瓶口,取出集气瓶正放桌上备用。
8. 电解结束后,关闭电源,清理电解池。
注意事项:
电解过程中,应确保使用的电源电压稳定,避免过高导致电解池损坏。
电解水时,正极产生氧气,负极产生氢气,两者均为易燃易爆气体,操作时应远离火源。
电解水产生的氧气纯度可能受到水中杂质的影响,实验前应对水进行适当处理,以提高氧气纯度。
电解过程中会产生大量热量,应注意散热,避免电解池过热。
通过以上三种方法,我们可以在实验室中有效制备氧气。每种方法都有其独特的优点和适用场景,选择时应根据实验需求、安全性及可操作性进行综合考虑。在实际操作中,务必遵循化学实验的基本规范,确保实验安全顺利进行。
- 上一篇: 邓稼先颁奖词的精彩汇总
- 下一篇: 手机贴膜秘籍:轻松掌握普通膜与钢化玻璃膜的完美贴合技巧
-
 揭秘:实验室中制取氧气的三大魔法公式与技巧资讯攻略11-14
揭秘:实验室中制取氧气的三大魔法公式与技巧资讯攻略11-14 -
 探索制取氧气的三大奇妙化学反应方程式资讯攻略11-14
探索制取氧气的三大奇妙化学反应方程式资讯攻略11-14 -
 探索六种创意方法:如何轻松制取氧气资讯攻略11-15
探索六种创意方法:如何轻松制取氧气资讯攻略11-15 -
 掌握制作氧气的三大关键方法资讯攻略11-14
掌握制作氧气的三大关键方法资讯攻略11-14 -
 揭秘!图形旋转的三大高效技巧资讯攻略11-12
揭秘!图形旋转的三大高效技巧资讯攻略11-12 -
 想知道妄想山海暮雪铃铛的独家获取秘籍吗?揭秘三大高效途径!资讯攻略10-23
想知道妄想山海暮雪铃铛的独家获取秘籍吗?揭秘三大高效途径!资讯攻略10-23












