探索制取氧气的三大奇妙化学反应方程式
在工业和实验室环境中,制取氧气是一项至关重要的任务,其方法多样,各具特色。以下是关于制取氧气的三种主要方法及其相应的化学方程式的详细描述。

第一种方法是利用过氧化氢(双氧水)在二氧化锰的催化作用下分解来制取氧气。这种方法在实验室中尤为常见,因其操作简便且安全性较高。化学方程式如下:
2H2O2(过氧化氢)→2H2O(水)+O2↑(氧气)↑表示气体生成

在这个反应中,过氧化氢分子在二氧化锰的催化下被分解成水和氧气。二氧化锰作为催化剂,不参与反应,仅加速反应进程,因此反应前后其质量和化学性质均不发生变化。生成的氧气以气泡的形式逸出,可以通过收集装置进行收集。
过氧化氢分解制氧法的优点在于反应条件温和,无需加热或加压,且反应速率适中,便于控制。此外,该方法所需的原料过氧化氢相对易得,成本较低。然而,需要注意的是,过氧化氢具有一定的腐蚀性,操作时需佩戴适当的防护用品。
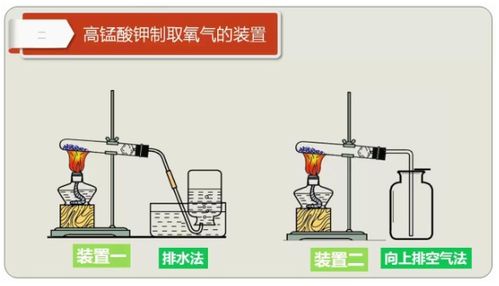
第二种制取氧气的方法是加热高锰酸钾。这种方法在实验室和工业中均有应用,尤其是在需要大量氧气时。化学方程式如下:
2KMnO4(高锰酸钾)→K2MnO4(锰酸钾)+MnO2(二氧化锰)+O2↑(氧气)
在此反应中,高锰酸钾固体在加热条件下分解为锰酸钾、二氧化锰和氧气。生成的氧气同样以气泡形式逸出,可通过集气装置收集。反应过程中,高锰酸钾的紫黑色逐渐褪去,最终变为锰酸钾的墨绿色和二氧化锰的黑色混合物。
加热高锰酸钾制氧法的优点在于原料易得,反应条件相对简单,且生成的氧气纯度较高。然而,该方法也存在一些缺点,如反应过程中需要加热,能耗较高;同时,生成的锰酸钾和二氧化锰混合物不易分离,可能影响后续操作。
第三种制取氧气的方法是分离液态空气法。这是一种工业上制取氧气的主要方法,因其能够高效地生产大量氧气而备受青睐。尽管这种方法不涉及具体的化学方程式,但其背后的物理原理和化学知识同样值得探讨。
分离液态空气法制氧的基本原理是利用空气中各组分沸点的不同进行分离。具体来说,空气首先被压缩并冷却至液态,然后送入蒸馏塔。在蒸馏塔中,液态空气被逐渐加热,由于氮气的沸点(-196℃)低于氧气的沸点(-183℃),因此氮气会先被蒸发出来,而氧气则留在蒸馏塔的底部。通过进一步处理,可以得到高纯度的氧气。
分离液态空气法的优点在于原料丰富(空气无处不在),且能够连续、大量地生产氧气。此外,该方法对环境的污染较小,符合绿色化学的理念。然而,该方法也存在一些局限性,如设备复杂、能耗较高以及分离过程中可能产生其他气体杂质等。
在实验室环境中,除了上述提到的过氧化氢分解法和加热高锰酸钾法外,还可以采用其他方法制取氧气,如电解水法。然而,电解水法由于能耗较高且产生的氢气不易处理,因此在实际应用中并不常见。相比之下,过氧化氢分解法和加热高锰酸钾法因其操作简便、原料易得等优点而更受实验室工作者的青睐。
值得一提的是,无论采用哪种方法制取氧气,都需要注意安全问题。例如,在加热高锰酸钾时,应确保加热装置稳定可靠,避免火灾或爆炸等意外事故的发生;在使用过氧化氢时,则需佩戴防护眼镜和手套等防护用品,以防止腐蚀性物质对皮肤和眼睛造成伤害。
此外,在收集氧气时,还需注意选择合适的收集方法和装置。对于过氧化氢分解法和加热高锰酸钾法产生的氧气,通常采用向上排空气法或排水法进行收集。向上排空气法利用氧气的密度大于空气的原理,将氧气从集气瓶口缓缓导入并排出空气;而排水法则利用氧气不易溶于水的性质,将氧气通入装满水的集气瓶中并排出水。
综上所述,制取氧气的方法多种多样,每种方法都有其独特的优点和局限性。在实际应用中,应根据具体需求选择合适的制取方法和装置。同时,无论采用哪种方法,都需严格遵守操作规程和安全规范,以确保实验或生产过程的顺利进行和人员的安全。
- 上一篇: 热红酒怎么做?
- 下一篇: 玉米煮多久才能熟透?
-
 揭秘:实验室中制取氧气的三大魔法公式与技巧资讯攻略11-14
揭秘:实验室中制取氧气的三大魔法公式与技巧资讯攻略11-14 -
 揭秘:实验室制取氧气的三大高效方法资讯攻略11-14
揭秘:实验室制取氧气的三大高效方法资讯攻略11-14 -
 探索六种创意方法:如何轻松制取氧气资讯攻略11-15
探索六种创意方法:如何轻松制取氧气资讯攻略11-15 -
 掌握制作氧气的三大关键方法资讯攻略11-14
掌握制作氧气的三大关键方法资讯攻略11-14 -
 轻松学会:红磷燃烧的化学方程式写法资讯攻略11-11
轻松学会:红磷燃烧的化学方程式写法资讯攻略11-11 -
 植物光合作用的化学反应式是什么资讯攻略11-11
植物光合作用的化学反应式是什么资讯攻略11-11